 |
| Sumber gambar: http://belajarkimia.com/ |
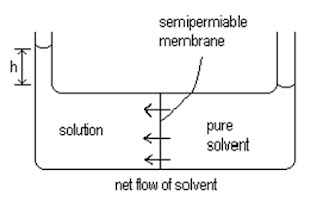
Osmosis adalah proses mengalirnya pelarut ke dalam larutan melalui selaput semipermeabel. Proses perembesan hanya terjadi dari larutan yang mempunyai konsentrasi yang kecil ke dalam larutan berkonsentrasi besar atau peristiwa mengalirnya molekul-molekul zat pelarut dari larutan yang lebih encer ke larutan yang lebih pekat. Selaput semipermeabel merupakan selaput yang hanya dapat dilewati oleh partikel-partikel dengan ukuran tertentu. Tekanan osmosis atau osmosa adalah tekanan yang diperlukan untuk menghentikan aliran pelarut ke dalam larutan.
∏ = tekanan osmotik larutan (atmosfir)
M = molaritas larutan (mol/L)
R = konstanta gas = 0,08205 L atm mol-1 K-1
T = suhu mutlak (°C + 273) K
Dalam hubungannya dengan konsentrasi larutan Van’t Hoff menyimpulkan bahwa tekanan osmosis larutan akan semakin besar apabila konsentrasi (Molar) dari zat terlarut semakin besar. Dua larutan yang mempunyai tekanan osmosis sama disebut larutan isotonik. Jika salah satu larutan mempunyai tekanan osmotik lebih rendah dari yang lain, larutan itu disebut hipotonik dan jika lebih tinggi dari yang lain, larutan itu disebut hipertonik. Osmosis memiliki peranan penting dalam kehidupan, misalnya penggunaan infus. Cairan infus harus Isotonik dengan darah.
Osmosis balik (Reverse Osmosis)
Osmosis balik dapat terjadi, apabila gaya atau tekanan yang diberikan di atas permukaan larutan melebihi tekanan osmotik larutan, sehingga partikel pelarut bergerak dari larutan ke air. Proses ini dapat digunakan untuk memperoleh air bersih dari air laut atau air kali.
Tekanan Osmosis Larutan Elektrolit
Berbeda dengan larutan non elektrolit, larutan elektrolit di dalam pelarutnya mempunyai kemampuan untuk mengion. Hal ini mengakibatkan larutan elektrolit mempunyai jumlah partikel yang lebih banyak daripada larutan non elektrolit pada konsentrasi yang sama. Dengan demikian, tekanan osmosis larutan elektrolit akan semakin besar jikan dibandingkan dengan larutan non elektrolit pada konsentrasi yang sama.
Persamaan tekanan osmosis larutan elektrolit dapat ditulis:
∏ = M R T i
Keterangan:
i = faktor van’t Hoff = 1 + (n-1) α
Hal-hal yang perlu diperhatikan berhubungan dengan larutan elektrolit antara lain:
1. a. Elektrolit yang menghasilkan dua ion (n = 2), yaitu CH3COOH, HCl, NaOH, NaCl.
b. Elektrolit yang menghasilkan tiga ion (n = 3), yaitu Ca(OH)2, H2SO4, Na2CO3,
MgCl2, CuCl2, Na2SO4.
MgCl2, CuCl2, Na2SO4.
c. Elektrolit yang menghasilkan empat ion (n = 4) yaitu FeCl3, AlCl3.
2. Makin banyak ion yang dihasilkan dari larutan elektrolit, makin besar pula harga ΔTb
dan ΔTf.
dan ΔTf.
3. Besarnya harga α menunjukkan kuatnya larutan elektrolit. Makin besar harga ∏, makin
besar pula harga ΔTb dan ΔTf.
besar pula harga ΔTb dan ΔTf.
4. Larutan elektrolit kuat mempunyai α = 1.
- ΔTb = Kb x m x n
- ΔTf = Kf x m x n
- ∏ = M x R x T x n
5. Pada elektrolit biner berlaku:
- ΔTb = Kb x m x (1 + α)
- ΔTf = Kf x m x (1 + α)
- ∏ = M x R x T x (1 + α)
CONTOH SOAL
Problem 1
Tekanan osmosa 17 gram suatu zat dalam 1 liter larutan pada suhu 27 °C adalah 1,5 atm. Berapakah Mr zat tersebut?
Solusi:
π = 1.5 atm
R = 0.082 atm.L/mol.K
T = 273 + 27 = 300 K
Persamaan tekanan osmosa : ∏ = M R T
1,5 = M . 0,082 . 300
M = 0.061 M
Mr dari zat tersebut dapat ditentukan dengan persamaan:
M = massa/Mr x 1000/V
0,061 M = (17 gram / Mr) x 1000/1000 mL
0,061 M = 17 / Mr
Mr = 17/ 0,061
Mr = 278
Problem 2
Sebanyak 18 gram glukosa (Mr = 180) dilarutkan kedalam air sampai volumenya 500 ml (0,5 liter). Jika suhu percobaan 27°C, tentukan tekanan osmosis larutan.
Solusi:
Diketahui:
M larutan = (18 gram/180 gram mol-1): 0,5 liter = 0,2 mol/L.
T = (27°C + 273) = 300 K.
Maka
∏ = M R T
= 0,2 mol/L x 0,08205 L atm mol-1 K-1 x 300 K-1
= 4,923 atm.
Tugas Mandiri:
1. Apakah yang dimaksud dengan tekanan osmotik?2. Berapa tekanan osmotik larutan sukrosa 0,0010 M pada suhu 25 °C?
3. Sebutkan kegunaan pengukuran tekanan osmotik!
—————————————————————————————————
Referensi:
http://id.wikipedia.org/wiki/Sifat_koligatif_larutan
http://www.e-dukasi.net/

Tidak ada komentar:
Posting Komentar